

Los cambios de estado en la materia
Cuando un cuerpo, por acción del calor o del frío pasa de un estado a otro, decimos que ha cambiado de estado. Por ejemplo, en el caso del agua, cuando hace calor, el hielo se derrite y si calentamos agua líquida vemos que se evapora. El resto de las sustancias también puede cambiar de estado si se modifican las condiciones en que se encuentran. Además de la temperatura, también la presión influye en el estado en que se encuentran las sustancias.
(Para más informacion y actividades sobre los estados de la materia has click en Estados de la materia
Los cambios de estado de la materia son:
- Fusión
- Vaporización
- Cristalización
- Solidificación
- Sublimación
- Condensación
Fusión
Si se calienta un sólido, llega un momento en que se transforma en líquido. Este proceso recibe el nombre de fusión. El punto de fusión es la temperatura que debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto de fusión característico. Por ejemplo, el punto de fusión del agua pura es 0 °C a la presión atmosférica normal.
Vaporización
Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de vaporización o evaporación. Cuando la vaporización tiene lugar en toda la masa de líquido, formándose burbujas de vapor en su interior, se denomina ebullición. También la temperatura de ebullición es característica de cada sustancia y se denomina punto de ebullición. El punto de ebullición del agua es 100 °C a la presión atmosférica normal.
La cristalización o sublimación inversa (regresiva) es el cambio de la materia del estado gaseoso al estado sólido de manera directa, es decir, sin pasar por el estado líquido.
Solidificación
En la solidificación se produce el cambio de estado de la materia de líquido a sólido, debido a una disminución en la temperatura. Este proceso es inverso a la fusión. El mejor ejemplo de este cambio es cuando metes al congelador un vaso de agua. Al dejarlo por unas horas ahí el agua se transforma en hielo (líquido a sólido), debido a la baja temperatura.
Sublimación
La sublimación o volatilización, es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
Condensación

Podemos decir entonces que en el estado sólido las partículas están ordenadas y se mueven oscilando alrededor de sus posiciones. A medida que calentamos el agua, las partículas ganan energía y se mueven más deprisa, pero conservan sus posiciones.
Cuando la temperatura alcanza el punto de fusión (0ºC) la velocidad de las partículas es lo suficientemente alta para que algunas de ellas puedan vencer las fuerzas de atracción del estado sólido y abandonan las posiciones fijas que ocupan. La estructura cristalina se va desmoronando poco a poco. Durante todo el proceso de fusión del hielo la temperatura se mantiene constante.
En el estado líquido las partículas están muy próximas, moviéndose con libertad y de forma desordenada. A medida que calentamos el líquido, las partículas se mueven más rápido y la temperatura aumenta. En la superficie del líquido se da el proceso de vaporización, algunas partículas tienen la suficiente energía para escapar. Si la temperatura aumenta, el número de partículas que se escapan es mayor, es decir, el líquido se evapora más rápidamente.
Cuando la temperatura del líquido alcanza el punto de ebullición, la velocidad con que se mueven las partículas es tan alta que el proceso de vaporización, además de darse en la superficie, se produce en cualquier punto del interior, formándose las típicas burbujas de vapor de agua, que suben a la superficie. En este punto la energía comunicada por la llama se invierte en lanzar a las partículas al estado gaseoso, y la temperatura del líquido no cambia (100ºC).
En el estado de vapor, las partículas de agua se mueven libremente, ocupando mucho más espacio que en estado líquido. Si calentamos el vapor de agua, la energía la absorben las partículas y ganan velocidad, por lo tanto la temperatura sube.

ACTIVIDADES
1- Completa la tabla respondiendo SI o NO, según corresponda.
| Estados de la materia | ¿Tiene forma definida? | ¿Ocupa un lugar en el espacio? | ¿Está constituido por materia? |
| Sólido | |||
| Líquido | |||
| Gaseoso |
2- Escribí el cambio de estado que se produce en cada situación.
| Situación | Cambio de estado |
Después de una ducha con agua caliente, en el espejo se ven gotitas de agua que escurren. |
|
| Cuando dejamos un trozo de chocolate al sol, se derrite. | |
| Si se coloca una taza con agua caliente cerca de una ventana, aparecen gotitas de agua en el vidrio. | |
| Si se deja una tetera con agua al fuego durante mucho tiempo, sale vapor de la tetera. | |
| Después de unas horas de estar al sol, la ropa húmeda se seca. | |
| La nieve de la cordillera se derrite. | |
| Cuando se coloca agua en el congelador, se forma hielo. | |
| En invierno, nieva en la cordillera. |
3- Completa el siguiente esquema con el nombre de los cambios de estado que experimenta el agua.
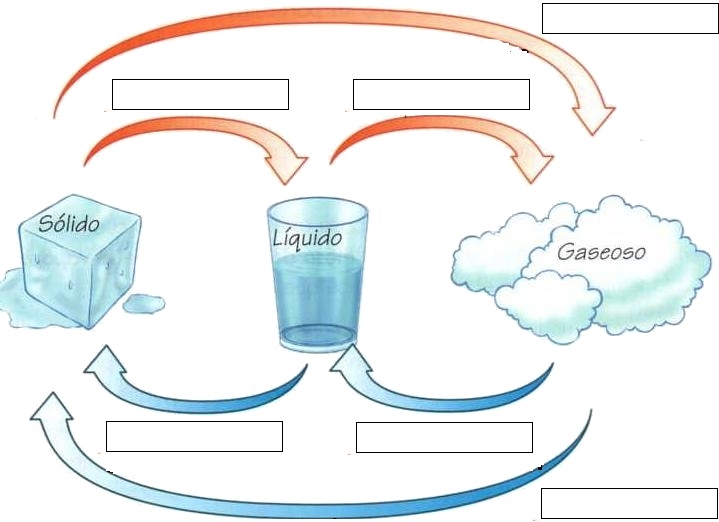
4- Marca con una X el casillero que corresponda según los cambios de temperatura que necesite el cambio de estado.
| Cambios de estado | Aumento de temperatura | Disminución de temperatura |
| De liquido a gaseoso | ||
| De liquido a sólido | ||
| De gaseoso a sólido | ||
| De sólido a liquido |